совокупность методов исследования с помощью электронных микроскопов (См.
Электронный микроскоп) (МЭ) микроструктуры тел (вплоть до атомно-молекулярного уровня), их локального состава и локализованных на поверхностях или в микрообъёмах тел электрических и магнитных полей (микрополей). Наряду с этим прикладным значением Э. м. является самостоятельным научным направлением, предмет и цели которого включают: усовершенствование и разработку новых МЭ и других корпускулярных микроскопов (например, протонного микроскопа) и приставок к ним; разработку методик препарирования образцов, исследуемых в МЭ; изучение механизмов формирования электроннооптических изображений; разработку способов анализа разнообразной информации (не только изображений), получаемой с помощью МЭ.
Объекты исследований в Э. м. - большей частью твёрдые тела. В просвечивающих МЭ (ПЭМ), в которых электроны с энергиями от 1
кэв до 5
Мэв проходят сквозь объект, изучаются образцы в виде тонких плёнок, фольги (
рис. 1), срезов и т. п. толщиной от 1
нм до 10
мкм (от 10 Å до 10
5 Å). Поверхностную и приповерхностную структуру массивных тел с толщиной существенно больше 1
мкм исследуют с помощью непросвечивающих МЭ: растровых (РЭМ) (
рис. 2), зеркальных, ионных проекторов (См.
Ионный проектор) и электронных проекторов (См.
Электронный проектор)
. Можно изучать порошки, микрокристаллы, частицы аэрозолей и т. д., нанесённые на подложку: тонкую плёнку для исследования в ПЭМ или массивную подложку для исследования в РЭМ. Поверхностная геометрическая структура массивных тел изучается и методом реплик (См.
Реплика)
: с поверхности такого тела снимается отпечаток в виде тонкой плёнки углерода, коллодия, формвара и др., повторяющий рельеф поверхности и рассматриваемый в ПЭМ. Обычно предварительно на реплику в вакууме напыляется под скользящим (малым к поверхности) углом слой сильно рассеивающего электроны тяжёлого металла (например, Pt), оттеняющего выступы и впадины геометрического рельефа. При исследовании методом так называемого декорирования не только геометрической структуры поверхностей, но и микрополей, обусловленных наличием дислокаций (См.
Дислокации) (
рис. 3), скоплений точечных дефектов (см.
Дефекты в кристаллах), ступеней роста кристаллических граней, доменной структуры (см.
Домены) и т. д., на поверхность образца вначале напыляется очень тонкий слой декорирующих частиц (атомы Au, Pt и др., молекулы полупроводников или диэлектриков), осаждающихся преимущественно на участках сосредоточения микрополей, а затем снимается реплика с включениями декорирующих частиц.
Специальные газовые микрокамеры - приставки к ПЭМ или РЭМ - позволяют изучать жидкие и газообразные объекты, неустойчивые к воздействию высокого вакуума, в том числе влажные биологические препараты. Радиационное воздействие облучающего электронного пучка довольно велико, поэтому при исследовании биологических, полупроводниковых, полимерных и т. п. объектов необходимо тщательно выбирать режим работы МЭ, обеспечивающий минимальную дозу облучения.
Наряду с исследованием статическим, не меняющихся во времени объектов Э. м. даёт возможность изучать различные процессы в динамике их развития: рост плёнок, деформацию кристаллов под действием переменной нагрузки, изменение структуры под влиянием электронного или ионного облучения и т. д. (исследования "in situ"). Вследствие малой инерционности электрона можно исследовать периодические во времени процессы, например перемагничивание тонких магнитных плёнок, переполяризацию сегнетоэлектриков (См.
Сегнетоэлектрики)
, распространение ультразвуковых волн и т. д., методами стробоскопической Э. м.:
электронный пучок "освещает" образец импульсами, синхронными с подачей импульсного напряжения на образец, что обеспечивает фиксацию на экране прибора определенной фазы процесса точно так же, как это происходит в светооптических стробоскопических приборах (См.
Стробоскопические приборы) (
рис. 4). Предельное временное разрешение при этом может, в принципе, составлять около 10
-15 сек для ПЭМ (практически реализовано разрешение Электр
онная микроскоп
ия 10
-10 сек для ПЭМ и РЭМ).
Для интерпретации изображений аморфных и других тел (размеры частиц которых меньше разрешаемого в МЭ расстояния), рассеивающих электроны диффузно, используются простейшие методы амплитудной Э. м. Например, в ПЭМ контраст изображения, т. е. перепад яркостей изображения соседних участков объекта, в первом приближении пропорционален перепаду толщин этих участков. Для расчёта контраста изображений кристаллических тел (
рис. 5), имеющих регулярные структуры (при рассеянии частиц на таких телах происходит
Дифракция частиц)
, и решения обратной задачи - расчёта структуры объекта по наблюдаемому изображению - привлекаются методы фазовой Э. м.: решается задача о дифракции электронной волны (см.
Волны де Бройля) на кристаллической решетке. При этом дополнительно учитываются неупругие взаимодействия электронов с объектом: рассеяние на плазмах, фононах и т. п. В ПЭМ и растровых ПЭМ (ПРЭМ) высокого разрешения получают изображения отдельных молекул или атомов тяжелых элементов; пользуясь методами фазовой Э. м., восстанавливают по изображениям трехмерную структуру кристаллов и биологических макромолекул. Для решения подобных задач применяют, в частности, методы голографии, а расчеты производят на ЭВМ.
Разновидность фазовой Э. м. - интерференционная Э. м., аналогичная оптической интерферометрии (см.
Интерферометр):
электронный пучок расщепляется с помощью электронных призм, и в одном из плеч интерферометра устанавливается образец, изменяющий фазу проходящей сквозь него электронной волн. Этим методом можно измерить, например, внутренний электрический потенциал образца.
С помощью лоренцовой Э. м., в которой изучают явления, обусловленные Лоренца силой (См.
Лоренца сила), исследуют внутренние магнитные и электрические поля или внешние поля рассеяния, например поля магнитных доменов в тонких пленках (
рис. 6), сегнетоэлектрических доменов (см.
Домены), поля головок для магнитной записи информации и т. п.
Состав объектов исследуется методами микродифракции, т. е. электронографии (См.
Электронография) локальных участков объекта, рентгеновского и катодолюминисцентного спектрального микроанализа (см
Катодолюминесценция, Спектральный анализ рентгеновский): регистрируются характеристические рентгеновские спектры или катодолюминисцентное излучение, возникающее при бомбардировке образца сфокусированным пучком электронов (диаметр электронного "зонда" менее 1
мкм). Кроме того, изучаются энергетические спектры вторичных электронов, выбитых первичным электронным пучком с поверхности или из объема образца.
Интенсивно разрабатываются методы количественной Э. м. - точное измерение различных параметров образца или исследуемого процесса, например измерение локальных электрических потенциалов (
рис. 7), магнитных полей (
рис. 8), микрогеометрии поверхностного рельефа и т. д. МЭ используются и в технологических целях (например, для изготовления микросхем методом фотолитографии (См.
Фотолитография)).
Лит.: Хокс П., Электронная оптика и электронная микроскопия, пер. с англ., М., 1974; Стоянова И. Г., Анаскин И. Ф., Физические основы методов просвечивающей электронной микроскопии, М., 1972; Утевский Л. М., Дифракционная электронная микроскопия в металловедении, М., 1973; Электронная микроскопия тонких кристаллов, пер. с англ., М., 1968; Спивак Г. В., Сапарин Г. В., Быков М. В., Растровая электронная микроскопия, "Успехи физических наук", 1969, т. 99, в. 4; Вайнштейн Б. К., Восстановление пространственной структуры биологических объектов по электронным микрофотографиям, "Изв. АН СССР. Сер. физическая", 1972, т. 36, № 9; Quantitftive scanning electron microscopy, L. - N. Y. - S. F., 1974.
А. Е. Лукьянов.
Применение электронной микроскопии в биологии позволило изучить сверхтонкую структуру клетки внеклеточных компонентов тканей. На основании результатов, полученных с помощью МЭ (максимальное разрешение которых для биологических объектов 12
- 6А, а увеличения
- до 800
- 1200 тыс.), начиная с 40-х гг. было описано тонкое строение мембран, митохондрий, рибосом и других клеточных, а также внеклеточных структур, выявлены некоторые макромолекулы, например ДНК. Растровая (сканирующая) Э. м. дает возможность изучать тонкое строение поверхности клеток и тканевых структур не только фиксированных объектов, но и живых животных с твердым хитиновым покровом, например ряда членистоногих. Техника приготовления биологических препаратов для Э. м. включает процедуры, сохраняющие ткань в условиях глубокого вакуума под пучком электронов и реализующие высокое разрешение МЭ. Обычно объекты фиксируют химическими реагентами (альдегидами, четырехокисью осмия или др.), обезвоживают (спиртом, ацетоном), пропитывают эпоксидными смолами и режут на специальных
Микротомах на ультратонкие срезы (толщиной 100
- 600 Å). Для повышения контраста изображения клеток их обрабатывают "электронными красителями", сильно рассеивающими электроны (уранилацетатом, гидроокисью свинца и др.). Чтобы уменьшить повреждающее действие фиксатора на ткань, ее можно заморозить, вытесняя затем воду ацетоном или спиртом при низкой температуре. Иногда применяют методы, исключающие действие фиксатора на клетки, например лиофилизацию (См.
Лиофилизация)
: ткань быстро охлаждают до
-150 или
-196°C и обезвоживают в высоком вакууме при низкой температуре. Перспективным оказался метод замораживания с травлением, основанный на получении платино-углеродной реплики со скола замороженного объекта. Благодаря этому методу внесены существенные изменения в представления о структуре клеточных мембран. Для изучения структуры биологических макромолекул и отдельных клеточных органоидов используют негативное контрастирование образцов. В этом случае исследуемые объекты выявляются в виде электроннопрозрачных элементов на темном фоне. Полученные в МЭ изображения молекул можно анализировать,
применяя методы, основанные на дифракции света (См.
Дифракция света)
. Использование высоковольтной Э. м. (до 3
Мв) позволяет получить сведения о 3-мерной структуре клеток. При подготовке к исследованию живых членистоногих их обездвиживают с помощью эфирного или хлороформного наркоза в дозах, не вызывающих последующей гибели, и помещают в вакуумную камеру МЭ. В современной Э. м. широко применяют методы цитохимии, включая авторадиографию (См.
Авторадиография)
. Применение Э. м. в биологии существенно изменило и углубило прежние представления о тонком строении клетки.
Лит.: Киселев Н. А., Электронная микроскопия биологических макромолекул, М., 1965; Электронно-микроскопическая анатомия, пер. с англ., М., 1967; Балашов Ю. С., Миккау Н. Е., Изучение живых животных в растровом электронном микроскопе, "Природа", 1977, № 1; Tribe М. A., Eraut M. R., Snook R. K., Basic biology course, book 2 - Electron microscopy and cellstructure, Camb., 1975; Electron microscopy of enzymes. Principles and methods, v. 1-2, N. Y., 1973-74.
Н. А. Старосветская, Я. Ю. Комиссарчик.
Рис. 7б. Измеренное вдоль резистора (ось Х, точки 1-7), на который подано напряжение, распределение потенциала U (измерение локального потенциала по сдвигу энергетического спектра вторичных электронов).
Рис. 1. Полученное в просвечивающем электронном микроскопе изображение сетки дислокаций на границах зёрен в тонкой молибденовой фольге, деформированной при высокотемпературном нагреве.
Рис. 2. Изображение предварительно отполированной, а затем подвергнутой ионной бомбардировке поверхности монокристалла меди. Снято в растровом электронном микроскопе. Увеличение 3000.
Рис. 3. Винтовые дислокации на поверхности кристалла NaCl, подвергнутого термическому травлению при температуре 500 °С. Изображение получено методом декорирования.
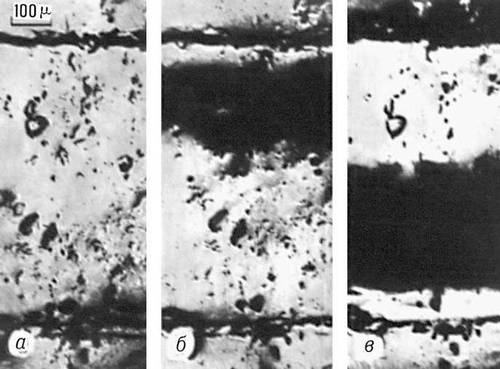
Рис. 4. Изображения поверхности кремниевого полупроводникового диода, полученные в стробоскопическом эмиссионном электронном микроскопе: а - напряжение на диоде отсутствует; б - на диод подано запирающее напряжение 40 в, появившаяся тёмная область - падение напряжения на р - n-переходе; в - кратковременное (менее 40 нсек) прямое падение напряжения (широкая тёмная область) на базе диода при переключении его в состояние, при котором он "отперт".
Рис. 5. Изображение атомной решётки плёнки золота. Расстояние между кристаллографическими плоскостями 2,04 Å. Снято в просвечивающем электронном микроскопе ЭМВ-100Л при электроннооптическом увеличении 350000 с последующим оптическим увеличением снимка.
Рис. 6. Изображение доменной структуры тонкой однородной по толщине пермаллоевой плёнки. Снято в просвечивающем электронном микроскопе при дефокусировке изображения (метод лоренцевой электронной микроскопии). Светлые и тёмные узкие полосы - границы доменов. Видна "рябь" намагниченности, возникающая вследствие малых изменений направлений векторов намагниченности (отмечены стрелками) внутри доменов.
Рис. 7а. Полученное с помощью растрового электронного микроскопа изображение участка интегральной микросхемы.
Рис. 8. Изображение линий равной напряженности поля (от 25 до 150 гс через 25 гс) над зазором магнитной головки (ширина зазора 2δ = 2 мкм) для магнитной записи информации. Получено в растровом электронном микроскопе со специальной приставкой.












![антарктического криля]] антарктического криля]]](https://commons.wikimedia.org/wiki/Special:FilePath/Krillfilter2kils.jpg?width=200)
